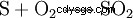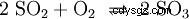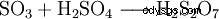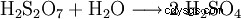| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 全般 | |||||||
| 名前 | 硫酸 | ||||||
| 他の名前 | 硫酸(VI)酸、ビトリオール油、ジヒドロ硫酸、モノチオン酸 | ||||||
| 分子式 | H2 SO4 | ||||||
| CAS 番号 | 7664-93-9 | ||||||
| 簡単な説明 | 無色無臭のやや粘稠な液体 | ||||||
| プロパティ | |||||||
| モル質量 | 98.08 g mol | ||||||
| 物質の状態 | 液体 | ||||||
| 密度 | 1.8356g cm | ||||||
| 融点 | 10.38℃ | ||||||
| 沸点 | 279.6 °C | ||||||
| 蒸気圧 | 1.3 hPa (145.8 °C) | ||||||
| 溶解度 | 水と完全に混和する | ||||||
| 安全上の注意 | |||||||
| |||||||
| MAK | 0.1 mg m (吸入可能なエアロゾル画分として測定) | ||||||
| LD50 | 2140 mg kg (ラット) | ||||||
| WGK | 1 - 水にわずかに危険 | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
硫酸 (IUPAC によると:硫酸二水素 )は、無色の粘稠な液体で、強い無機酸です。これは鉱酸の 1 つであり、化学産業で最も重要な 20 の化学物質の 1 つです。食品添加物としての番号は E 513 です .希硫酸 希酸といいます。 19 世紀まで、硫酸はビトリオール オイル (ビトリオール由来) という些細な名前も持っていましたが、今日では使用されていません.
硫酸の塩とエステル 硫酸塩、硫酸水素塩と呼ばれます。塩のような硫酸塩には、硫酸イオン (SO4 ).
取得と表示
過去には、硫酸はビトリオールプロセスとリードチャンバープロセスを使用して製造されていました。現代の工法はコンタクト工法とそこから発展したダブルコンタクト工法です。
硫酸を製造するための最も古いプロセスは、ビトリオールプロセスです。 13世紀に錬金術師によって使用されました。ビトリオールは、熱分解して三酸化硫黄と金属酸化物を形成するのが比較的容易な硫酸塩です。 Johann Rudolph Glauber (1604–1670) は世界初の硫酸工場を建設し、このプロセスを使用して 1650 年頃にノルトハウゼン (ハルツ) で硫酸を製造しました。
接触プロセスでは、元素硫黄 (S) と酸素 (O2 ) 二酸化硫黄 (SO2 ) が表示されます:
二酸化硫黄は、五酸化バナジウム (V2 O5 ) を触媒として、三酸化硫黄 (SO3 ) 実装:
三酸化硫黄は硫酸の無水物です。水への溶解度が低いため、水に直接導入するのではなく、濃硫酸に導入すると、非常によく吸収されます。
形成された二硫酸は水で連続的に希釈されます。
プロパティ
分子式H2の硫酸 SO4 は強酸 (pK
硫酸は水と共沸混合物を形成します。 100% 硫酸を沸騰させると、三酸化硫黄が蒸発して濃度が約 98% に達します。逆に、希硫酸は煮沸することでこの濃度にすることができます。
100%硫酸は、無水になるまで約98重量%の硫酸中に三酸化硫黄をバブリングすることによって調製される。硫酸はまた、大量の三酸化硫黄を結合することができ、その結果生じる液体は、その粘度が高いため発煙硫酸と呼ばれます。オレウムは、硫酸とポリ硫酸の混合物で構成されています (二硫酸:H2 S2 O7 、三硫酸H2 S3 O10 など) 最大 65 重量% の三酸化硫黄を含むオレウムが市販されています。発煙硫酸は、スルホン化のための化学反応で、または反応からできるだけ多くの水を結合する必要がある場合に使用されます。これにより、硫酸の消費が最小限に抑えられ、多くの場合、収率が最大になります。
濃度を決定するために、硫酸の密度が測定されます。したがって、濃度は標準表から直接推定できます。たとえば、自動車のバッテリーの充電状態が決定されます (鉛蓄電池も参照してください)。
濃硫酸を希釈するときは、大量の熱が放出されます。したがって、適切な予防措置を講じる必要があります。 常に 酸 水 混合されている、つまりない 酸の水 !そうしないと、水が爆発的に蒸発し、液体が制御不能に噴出する可能性があります。危険は明らかです。ニーモニック:「まず水、次に酸。さもないと恐ろしいことが起こる」
意味と使い方
硫酸は、最も一般的に生産される化学物質の 1 つです。 1997 年には、世界中で 1 億 3000 万トン以上が生産されました。可能なアプリケーションは非常に多様です。硫酸が使われています
- 鉱石の消化 (例:酸化チタン (IV) またはウランの消化)
- 硫酸塩の生産
- 他の酸 (フッ化水素酸やリン酸など) の製造
- 硝酸による肥料の生産
- 界面活性剤の製造
- 触媒として
- 金属処理用
- 乾燥剤として
- 反応助剤(硝酸)として
- 車のバッテリー
- 半導体のエッチング用
- 電気分解における水への添加剤としての導電性のため
- 喫煙時の溶剤として
- ポリアミドの粘度数を決定するための分析
- 二酸化チタンの製造
食品産業では、加工デンプンとカゼインを製造し、飲料水を処理するための技術添加物として硫酸が使用されています。それは最終製品には流れないため、存在しないか、健康に無害な微量にしか存在しません.欧州連合では、製品パッケージに硫酸を表示する必要はありません。
飽和するまで硫酸に過マンガン酸カリウムを溶解すると、強力な酸化剤である暗緑色の油状液体 (七酸化二マンガン) が生成されます。木材などの有機物をすぐに焦がし、アセトンやその他の燃料で自然発火します。二クロム酸カリウムを硫酸に溶解することにより、実験室での洗浄目的で過去に一般的に使用されていた物質であるクロム硫酸が得られます.
生産された硫酸の量は、国の化学産業の効率の指標でした。大量の硫酸は、化学産業の II 開発段階で消費されます。
開発段階:
- I. 主な苛性ソーダの消費量
- II. 主な硫酸消費量 III.一般的な塩素消費量
構造と結合
硫酸分子では、硫酸水素陰イオンと同様に、硫黄原子は歪んだ四面体配位を持っています。 OH 基への 2 つの S-O 結合は、2 つの「裸の」酸素原子への結合よりも著しく長い。見つかった結合長は、1 および 2 の結合次数に対応します。しかし、(共有) 二重結合を使用し、形式電荷を使用せずに頻繁に使用される表記法では、4 つの酸素原子の硫黄への結合は、次の 3d 軌道を使用しないと説明できません。 π 結合の硫黄が使用されます (PSE を参照)。ただし、詳細な理論的考察は、d軌道が主族元素化合物の結合にほとんど寄与しないことを示しています。したがって、「裸の」酸素原子へのより短い結合は、追加の静電相互作用によって短縮される共有単結合としてより適切に説明されます。電荷分離は、オクテット規則に従う単一メソメリック境界構造から導き出すことができます。
証明
硫酸は、硫酸陰イオンの形で検出できます。例えば、塩化バリウム溶液を加えた後の難溶性の微結晶性硫酸バリウムとしての沈殿は、硫酸塩の検出として機能します。
重要なつながり
塩:
- 硫酸銅(銅ビトリオール)
- 硫酸カルシウム (石膏、アラバスター、硬石膏) (CaSO4 )
- 硫酸バリウム (バライト、ヘビースパー) (BaSO4 )
- みょうばん (他の陽イオンと混合した硫酸塩アルミニウム)
- アルミナイト
- 硫酸鉄(鉄ビトリオール)
- 硫酸ナトリウム(グラウバー塩)
エステル:
- 硫酸ジメチル (溶媒、メチル化剤; 非常に有毒)
ソース
<オール>- 亜硫酸H2 SO3 (亜硫酸二水素)
- 硫酸露点