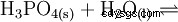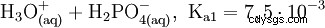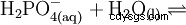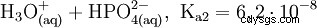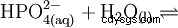| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 全般 | |||||||
| 名前 | リン酸 | ||||||
| 他の名前 | オルトリン酸 | ||||||
| 分子式 | H3 PO4 | ||||||
| CAS 番号 | 7664-38-2 | ||||||
| 簡単な説明 | 無色無臭の固体 | ||||||
| プロパティ | |||||||
| モル質量 | 98.00 g mol | ||||||
| 物質の状態 | 固体 (過冷却された溶融物は長期間保存できるため、多くの場合液体) | ||||||
| 密度 | 1.834g cm (18°C) | ||||||
| 融点 | 42.35°C | ||||||
| 沸点 | 分解:213 °C (脱水) | ||||||
| 蒸気圧 | 3.8 Pa (20 °C) | ||||||
| pKa値 | 2.16; 7.21; 12.32 | ||||||
| 溶解度 | 水と完全に混和し、アルコールに易溶 | ||||||
| 安全上の注意 | |||||||
| |||||||
| MAK | 2 mg m (呼吸可能なエアロゾル画分) | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
通常 または直交- リン酸 リンの主な酸です。無水物は吸湿性が高い。これは三塩基酸であり、最初の脱プロトンに対して適度に強い酸として反応します。縮合物の二リン酸、メタおよびポリリン酸は、それから誘導されます。食品添加物として、リン酸はE 338としてリストされています
取得と表示
リン酸は、リン鉱石から得ることができます (主にアパタイト、Ca5 (PO4 )3 (F, OH, Cl)) 硫酸、塩酸または硝酸で。副産物として CaSO4 が形成される (硬石膏、石膏) および H2 [SiF6 ] (ヘキサフルオロケイ酸)。あるいは、リン元素を燃焼させて五酸化リン、P4 を形成することによって、リン酸を得ることができます。 O10 、およびその後の加水分解 (いわゆる熱リン酸)。
プロパティ
リン酸は三塩基酸であり、その水素を 3 段階で溶媒和プロトンとして供与して、リン酸二水素、リン酸水素、およびリン酸アニオンを形成します。関連する pKs 値は pK
使い方
リン酸は、リン酸含有肥料 (米国での生産の 90% 以上)、洗剤、錆除去剤または錆転換剤の製造の原料として、また腐食から保護するための鉄と亜鉛の不動態化の原料として使用されます。リン酸亜鉛セメントは歯科で使用されます。
高濃度では苛性効果がありますが、リン酸は人体に無毒であるため、食品業界では防腐剤、酸性化剤 (特にコーラ飲料) として、また酸性度調整剤 (E 338) として希釈して使用されます。 、そのコースティック効果は別として。緩衝液(各種「リン酸緩衝液」)の調製にも適しています。
生物学的重要性
リン酸エステルは、代謝において中心的な役割を果たし、特にエネルギーおよびグループ キャリアとして機能します (ATP および GTP などを参照)。それらは、DNA、RNA、多くの補酵素などの不可欠な部分です.
証明
リン酸と可溶性リン酸塩は、モリブデン酸アンモニウムで沈殿させて黄色のリン酸モリブデン酸アンモニウムを形成するか、またはアンモニア溶液中でマグネシウムイオンで沈殿させて MgNH4 を形成することによって分離できます。 PO4 証明してください。
ソース
<オール>- リンの他の酸素化合物