| 構造体 | |||||||
|---|---|---|---|---|---|---|---|
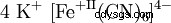 | |||||||
| Allgemeines | |||||||
| 名前 | カリウムヘキサシアニド鉄(II) | ||||||
| アンデレ・ナメン |
| ||||||
| Summenformel | C6 FeK | ||||||
| CAS 番号 |
| ||||||
| クルツベシュライブン | zitronengelbe Kristalle | ||||||
| 固有値 | |||||||
| モル質量 | 368,34 g·mol (wasserfrei) | ||||||
| 集合体 | 祭り | ||||||
| ディヒテ | 1,85 g/cm (wasserfrei) | ||||||
| シュメルツプンクト | bei ca. 70 °C クリスタルワッセラブガベ デ トリヒドラート | ||||||
| シーデプンクト | > 400 °C (Zersetzung) | ||||||
| Löslichkeit | ワッサー中のガットロスリッチ:337 g/l (20 °C) | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| MAK | ニヒト・フェストゲレグト | ||||||
| WGK | 2 | ||||||
| SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
カリウムヘキサシアニド鉄(II) ist ein Salz mit der Konstitutionsformel K
ヘルステリング
Hergestellt wird Kaliumhexacyanidoferrat(II) aus einer Eisen(II)-Salzlösung und Kaliumcyanid. Es enthält dann Kristallwasser undliegt als K
Unter Normalbedingungen ist das Hexacyanidoferrat(II)-Ion jedoch ein stabiler Komplex, es ist daher ungiftig.
Früher wurde Kaliumhexacyanidoferrat(II) durch Glühen von eingetrocknetem Blut, Hornspänen und anderen tierischen Substanzen mit Eisenspänen und Pottasche hergestellt, daher auch die Bezeichnung als Gelbes Blutlaugensalz.
Verwendung
In der Analytik wird das Salz zum Nachweis von Eisen(III)-Ionen verwendet. In Lösung erhält man bei Zugabe von Fe-Ionen zunächst lösliches Berliner Blau, K[FeFe(CN)6 ], durch einen uberschuss fällt unlösliches Berliner Blau aus, Fe[FeFe[(CN)6 ]3 . Diese Reaktionen dienen zum Nachweis von Eisen(III)-Ionen:
Aus Kaliumhexacyanidoferrat(II) lässt sich durch Oxidation mit Wasserstoffperoxid Kaliumhexacyanidoferrat(III) herstellen.
In der Lebensmittelindustrie wird Kaliumhexacyanidoferrat als Trennmittel und Stabilisator verwendet. Es darf in Lebensmitteln jedoch nur in geringen Mengen verwendet werden, da sich beim Erhitzen or bei Einwirkung von Säuren Blausäure bilden kann.Es ist in der EU als Lebensmittelzusatzstoff der Bezeichnung E536 ausschließlich für die Verwendung in Kochsalz und Kochsalzersatz zugelassen.
クエレン
<オール>- カリウムヘキサシアニド鉄(III) (rotes Blutlaugensalz)
- シアン化物

