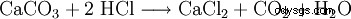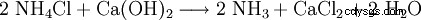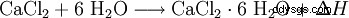| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 構造式がありません | |||||||
| 全般 | |||||||
| 名前 | 塩化カルシウム | ||||||
| 他の名前 |
| ||||||
| 分子式 | CaCl2 | ||||||
| CAS 番号 | 10043-52-4 (無水) 10035-04-8 (二水和物) 25094-02-4 (四水和物) 07774-34-7 (六水和物) | ||||||
| 簡単な説明 | 無色無臭の吸湿性結晶 | ||||||
| プロパティ | |||||||
| モル質量 | 110.98 g mol (無水) 147.02 g mol (二水和物) 182.04 g mol (四水和物) 219.08 g mol (六水和物) | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 2.16 g cm (無水) 1.85 g cm (二水和物) 1.71 g cm (六水和物) | ||||||
| 融点 | 782 °C (無水) 約。 176 °C (二水和物) 約。 35 °C (四水和物) | ||||||
| 沸点 | 1935 °C | ||||||
| 蒸気圧 | 11hPa | ||||||
| 溶解度 |
水に易溶:740 g l (20 °C) | ||||||
| 安全上の注意 | |||||||
| |||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
| |結晶構造 ||ルチル (歪んだ)、八面体塩化カルシウム (塩化カルシウムも ) は、分子式 CaCl2 のアルカリ土類金属カルシウムの塩化物です。 .カルシウムの酸化状態は +2、塩素の酸化状態は -1 です。
歴史
1860 年頃、化学者のロバート ヴィルヘルム ブンゼンとマシーセンは、塩化カルシウムの電気分解による元素カルシウムの最初の純粋な調製に成功しました。
オカレンス
塩化カルシウムは塩水に溶けて自然界に存在します。
取得と表示
塩化カルシウムは、塩酸と炭酸カルシウムから作られます:
続いて 260 °C まで加熱すると、無水型が得られます。
技術的には、塩化カルシウムは、ソルベイ プロセスによるソーダの製造からの廃棄物として得られます。つまり、生成された塩化アンモニウムからアンモニアが回収される場合です。
プロパティ
塩化カルシウムは塩です。カルシウムと塩素は電気陰性度の差が大きいため、イオンとして存在します。したがって、結合は静電相互作用によって行われます。
純粋な形では、塩化カルシウムは無色の結晶を形成し、無水の場合は吸湿性が高くなります。周囲から水分を容易に吸収し、ハイドレート複合体を形成します。
反応
塩化カルシウムは水と反応して六水和物錯体を形成し、大量の熱を発生します (発熱、ΔH> 0):
六水和物の結晶は、約 30 °C でそれ自体の結晶水に溶解します。約 200 °C に加熱すると、結合水が再び放出されます。無水塩化カルシウムとは対照的に、水に溶解すると、強力な冷却につながります。どちらの形態の塩化カルシウムも、エタノールに容易に溶けます。
使い方
吸湿性があるため、無水塩化カルシウムは、デシケーターなどの実験室や、さまざまな気体や液体の技術化学において重要な乾燥剤です。適用分野は、生活空間の乾燥、不凍液としての使用、特にコンクリートの不凍液および硬化促進剤としての使用、および粉塵結合剤 (建設現場など) としての使用です。医学では、止血やカルシウム欠乏症の治療、しもやけやアレルギーの治療に使用されます。
引き締め剤、風味増強剤、安定剤として使用されます (飲料水処理、果物の表面処理など)。EU では、食品添加物として E 509 と番号が付けられています。 承認されました。
塩化カルシウムは、水と反応する際の発熱水和を利用して、すぐに飲める飲料を加熱するために使用されます. また、道路塩として、および冷却混合物の製造にも使用されます (上記を参照 ).
また、食品技術でタンパク質を凝固させるためにも使用され、豆腐や人工キャビアなどの製品の製造にも使用されます.