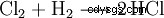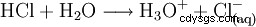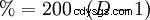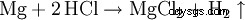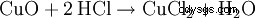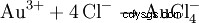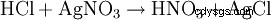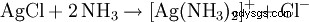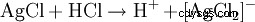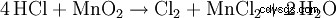| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 構造式がありません | |||||||
| 全般 | |||||||
| 名前 | 塩酸 | ||||||
| 他の名前 |
| ||||||
| 分子式 | 該当なし | ||||||
| CAS 番号 | 7647-01-0 | ||||||
| 簡単な説明 | 刺激臭のある無色から黄色がかった液体 | ||||||
| プロパティ | |||||||
| モル質量 | 該当なし | ||||||
| 物質の状態 | 液体 | ||||||
| 密度 | 1.19 g cm (37% 溶液) | ||||||
| 融点 | −35 °C (36%溶液) | ||||||
| 沸点 | 57 °C (36% 溶液) | ||||||
| 蒸気圧 | 127 hPa (20 °C、36% 溶液) | ||||||
| 溶解度 | 塩化水素は、37% の濃度まで水に溶解できます | ||||||
| 安全上の注意 | |||||||
| |||||||
| MAK | 2 ml m または 3.0 mg m | ||||||
| WGK | 1 - 水にわずかに危険 | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
塩酸 (系統名 塩酸 ) ガス塩化水素 (化学式 HCl) の水溶液です。これは強い無機酸であり、無機酸の 1 つです。塩酸の塩は塩化物と呼ばれます。最もよく知られている塩化物は塩化ナトリウム (NaCl、食塩) です。
歴史
塩酸は、最初の錬金術師に知られていたに違いありません。それらの発見は、1 世紀のマリア・プロフェティッサと 9 世紀のゲーベルによるものとされています。
すでに 15 世紀前半には、バシリウス ヴァレンティヌスが岩塩 (岩塩) と鉄ビトリオールを反応させて塩酸を得ていました。ヨハン・ルドルフ・グラウバーは、17世紀に食卓塩と硫酸からそれを製造することに成功しました.塩酸 acide muriatique と呼ばれるラヴォアジエ (緯度 ムリア=ブライン)。塩水泉は今でも Muriatic springs と呼ばれています 専用。北米では、塩酸はムリア酸とも呼ばれます。
オカレンス
自然界では、塩酸は火山ガスや火口湖の希薄溶液に含まれています。脊椎動物の胃液中に遊離型で存在します (0.1 ~ 0.5 質量パーセント)。塩酸の塩の堆積物は、岩塩のように海水に溶けてほとんど無尽蔵です。
取得と表示
塩酸は実験室で濃硫酸と食塩から生成されます (名前の由来):
塩化水素はより強い酸ですが、硫酸はその塩から塩化水素を置換します。これが可能なのは、塩化水素が気体であり、硫酸にほとんど溶けないためです。その結果、塩化水素は常に平衡から消えます。得られた硫酸塩は、酸性塩である硫酸水素ナトリウムです。
化学産業では、塩素起爆ガス (水素と塩素の混合物) を燃焼させることにより、高純度の塩化水素が得られます。
酸を完成させるには、塩化水素ガスを水に溶かします:
技術的に純粋な塩酸は、主に有機化合物の塩素化の副産物です。
プロパティ
| % HCl | g HCl/l | モル濃度 | 密度 |
|---|---|---|---|
| 10.5 | 110 | 3.06 | 1,050 |
| 15.5 | 166 | 4.61 | 1,075 |
| 20.4 | 224 | 6,22 | 1,100 |
| 22,3 | 248 | 6.89 | 1,110 |
| 24,3 | 272 | 7.56 | 1,120 |
| 26,2 | 296 | 8,22 | 1,130 |
| 28,2 | 321 | 8.92 | 1,140 |
| 30,1 | 347 | 9.64 | 1,150 |
| 32,1 | 372 | 10,23 | 1,160 |
| 34,2 | 400 | 11,11 | 1,170 |
| 36,2 | 428 | 11.89 | 1,180 |
| 38,3 | 456 | 12.67 | 1,190 |
| 40,4 | 485 | 13,47 | 1,200 |
0 °C では、HCl ガスは水によく溶けます (水がまだ液相の場合) (1 リットルで 815 g または 507 リットル)。これにより熱が発生します。 25 °C では、1 リットルの飽和塩酸には 825 g の HCl (42.7%) が含まれます。溶液の密度は1.20 g cmです。密度の濃度依存性を次の表に示します。密度と HCl のパーセンテージ含有量の間にはランダムな数学的関係があります。 B. 1.10 g cm は 20% 塩酸の密度です。
HCl 含有量が 36 重量パーセントを超える塩酸は、発煙塩酸とも呼ばれます。 開いた容器の上に白い霧が形成されるため、示されます。
純粋な塩酸は、残留物を残さずに蒸発させることができます。重量で 20% を超える HCl 含有量の塩酸を加熱すると、共沸混合物として知られる 20% の HCl と 80% の水の混合物が残るまで、水よりも多くの HCl が逃げます。 1013 mbar での共沸混合物中の HCl の正確な含有量は 20.17% で、沸点は 110 °C です。
HCl は水中で完全に解離し、濃塩酸 (32%) の pH 値は -1 です。湿った空気の中で、HCl ガスは塩酸の細かい液滴のミストを形成します。
希塩酸は電気の良導体です。
反応
塩酸は、貴金属を除くほとんどの金属を溶解します。タンタル (ゲルマニウム)、銅、水銀 (酸素の存在下のみ)、および銀は、パッシベーションで保護されていない限り、塩化物と水素を形成します。
金属酸化物が塩酸と反応して塩化物と水を生成するため、鋼からさびをすばやく除去するのに非常に適しています。
塩酸と硝酸の混合物は、「金属の王様」である金も溶かすことができるため、王水と呼ばれます。塩化ニトロシルと発生期塩素の酸化効果に加えて、錯体形成による有効金イオン濃度の低下も次の原因となります。
使い方
塩酸は無機酸として化学工業において非常に重要です。塩酸は、鉱石やリン酸塩の処理などに使用されます。油田やガス田の酸処理や、酸洗、エッチング、はんだ付けのための金属加工に使用されます。
塩酸は化学分析において重要な試薬です。沈殿によって金属のグループを他の金属から分離することができます。これらは、さらに個別に分析できます (塩酸グループを参照)。アルカリ分析は、塩酸のもう 1 つの用途です。
食品添加物として、塩酸は E 507 と指定されています。
生物学的重要性
人間や動物では、塩酸は胃液の成分であり、特に脂肪の加水分解を引き起こしますが、さらに消化器系に入る前に細菌を殺す役割も果たします.
安全上の注意
皮膚に接触すると、化学熱傷を引き起こします。蒸気は刺激性があります. 目に入った場合は、すぐに多量の水で洗い流し、医師の診察を受けてください.事故が発生した場合や気分が悪い場合は、すぐに医師の診察を受けてください。
証明
一方では、塩酸はその酸性特性によって検出されます。さらに、塩化銀の形で硝酸銀を用いて沈殿させることにより、高度に希釈された溶液で塩化物陰イオンを同定します。
得られた白色の沈殿物は、アンモニア水または濃塩酸に溶解し、複合体を形成します。
二酸化マンガンの存在下で塩酸を加熱すると、塩素ガスが生成されます:
塩酸の含有率は、苛性ソーダ滴定(→酸度測定、容量分析)によって決定されます。この測定は、塩化物の測定と同様に、クロラニル酸の水銀塩を使用して測光法で行うことができます。胃液中の塩酸含有量は、ギュンツブルグ試薬を使用して測定されます。