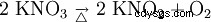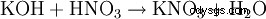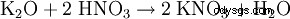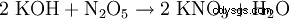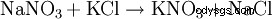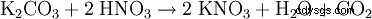| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| K | |||||||
| 全般 | |||||||
| 名前 | 硝酸カリウム | ||||||
| 他の名前 |
| ||||||
| 分子式 | KNO3 | ||||||
| CAS 番号 | 7757-79-1 | ||||||
| 簡単な説明 | 白い結晶性粉末 | ||||||
| プロパティ | |||||||
| モル質量 | 101.11 g mol | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 2.109 g cm (16 °C) | ||||||
| 融点 | 334 °C | ||||||
| 沸点 | 分解>400 °C | ||||||
| 溶解度 | 水に良好 (20 °C で 316 g/L)、非極性溶媒に弱い | ||||||
| 安全上の注意 | |||||||
| |||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
硝酸カリウム 、一般的な用語では硝石としてよく知られています 、具体的には硝酸カリウム 、硝酸のカリウム塩です。
プロパティ
硝酸カリウムは無色の結晶を形成し、強い冷却により水に溶解します。したがって、冷水よりもぬるま湯に溶けやすいのです。 0°Cの水1リットルに最大130gの硝酸カリウムを溶かすことができ、100°Cの水1リットルに最大2455gの硝酸カリウムを溶かすことができます.このような高濃度では、溶液の密度は純水の密度よりも大幅に大きくなります。
硝酸カリウムは、加熱すると亜硝酸カリウムと酸素に分解します:
高温での優れた酸化剤です。ガラス製品の焦げた残留物は、溶融した硝酸カリウムにすぐに溶けます。
硝酸カリウムは、他の多くの硝酸塩よりも吸湿性が大幅に低いです。 B. 硝酸ナトリウム。
抽出
- 自然発生
硝酸カリウム (min. "Nitrokalit") は、土壌の白華として発生します。中国と東南アジアの鉱床は経済的に重要であり、19 世紀前半には、そのような土壌から浸出することにより、年間 10,000 トン以上の硝石が抽出されました。
- 窒素に富む有機廃棄物の細菌による硝化 14 世紀末から 19 世紀にかけて、戦争目的で不可欠な原料である硝石を輸入せずに済むように、バクテリアと大気中の酸素を利用して硝石がヨーロッパで生産されました。 (「歴史」を参照)。窒素が豊富な有機性廃棄物 (糞と尿) は、石灰と木の灰 (カリ) と混合され、ゆるくて通気性のある土の山に分解されます。窒素化合物はバクテリアによって硝酸塩に変換されます。 2年後、塊は水で浸出されます。生の灰汁にカリを加えることで、硝酸カルシウムと硝酸マグネシウムを硝酸カリウムと難溶性のアルカリ土類炭酸塩に変換します。硝酸カリウムは、ろ過された灰汁を蒸発させて得られ、再結晶によって精製されます。
- 変換硝石
19 世紀半ばから 1920 年頃まで、塩化カリウムによるチリの硝酸塩の変換は、硝酸カリウム:NaNO3 を生成するための最も重要なプロセスでした。 + KCl --> KNO3 + NaCl
温度による塩化ナトリウムの溶解度のわずかな増加がここで使用されます:KNO3 の母液 -前のサイクルの結晶化を加熱し、化学量論比で粗製の硝酸ナトリウムと塩化カリウムを加えます。少量のソーダを100℃で添加して混合物を濃縮し、その間に塩化ナトリウムおよび不純物(アルカリ土類金属炭酸塩)が沈殿し、濾別する。冷却中のナトリウム塩の沈殿を避けるために濾液を蒸発からの凝縮物で再度希釈し、濾過して透明にし、次いで5℃に冷却して硝酸カリウムを結晶化し、遠心分離する。分離された硝酸カリウムは、技術的な目的のために再結晶化されます。
- 硝酸から合成
今日、硝酸カリウムは合成的に生産されています (表現を参照) ).
外観 (クラフト)
硝酸カリウムを表す方法はたくさんあります:
- ほぼすべての塩生成反応により:
- 炭酸カリウムから:
使い方
- 硝酸カリウムは食品の保存に使用されます (硬化塩 E 252)
- 黒色火薬やその他の火薬混合物の製造に使用
- 24% ホウ素 + 71% KNO3 の混合物 + 5% バインダー (PMMA) は、非常に低い温度 (-196°C) でも燃焼する、信頼性の高い点火混合物として機能します。
- 60% NaNO3 のブレンド +40% KNO3 222°Cで溶け、太陽熱発電所の熱伝達媒体として使用されます。この溶融塩は 590 °C まで化学的に安定で、1.55 kJ/(kg K) の高い比熱容量、1.79 g/cm³ の密度を持ち、水のように薄い (粘度:2.1 mPa s)。金属表面を非常に簡単に濡らすため、構造と材料の選択が不適切な場合、シーリングの問題が発生する可能性があります。ステンレス鋼は、硝酸塩溶融物に対して非常に耐性があります (侵食速度:570 °C で 6 - 15 µm/年)。乱流パイプでの熱伝達係数は約 6000 W/K m² です。熱容量が大きいため (2.8 MJ/(K m³))、硝石溶融物は蓄熱媒体としても適しています。亜硝酸ナトリウムを添加することにより、融解温度をさらに下げることができます。 HiTec と呼ばれる 53% KNO3 の塩混合物 + 40% ナノ2 + 7% ナノ3 140°C で融解し、亜硝酸ナトリウムの毒性が関係ない場合、熱伝達媒体として特に好ましい特性を持っています。
- 硝石浴は、マグネシウム含有量が最大 10% の鍛造アルミニウム合金の熱処理に使用されます。溶融塩の最大許容温度は、マグネシウムの含有量によって異なります。 0.5% Mg での 550°C から 10% Mg での 380°C まで低下します。
- スモークグレネード
- 肥料中
歴史
すでに 11 世紀に、Marcus Graecus の本で硝石が言及されており、この本では、土や石から削り取られた新しい物質として、初めて黒色粉末の混合物についても言及されています。 Hassan ar-Rammah (Al-Furusiyya wa al-Manasib al-Harbiyya) による 13 世紀後半の騎乗戦闘と戦争機械の使用に関する本 ) にはすでに、硝石を木灰で浄化するための規則、およびロケット用の焼夷弾と燃料を準備するための規則がいくつか含まれています。
硝石は当初、インドから輸入されました。ヴェネツィアは中間貿易から大きな利益を得ました。需要の増加と独立の理由から、14 世紀の終わりから、政府は独自の硝石の生産を促進し、「硝石政権」を通じて厳格な法律によって、生産、輸入、および使用に対するすべての権利を確保しました。酸素が急速に放出されるため、硝石は火薬中の硫黄と木炭の突然の燃焼の基礎となり、そのため、慢性的に希少な物質として、6 世紀にわたって戦略的原料となりました。
テューリンゲン州では、16 世紀に 9 つの硝石工場がありました。プラハ近郊のヴルタヴァ川の土手は「衛生ベンチ」で覆われ、ハレ市はゴミ捨て場から硝石を抽出する許可を与えました。硝石の需要の増加は、主にインドからのさらなる輸入と自社工場によって部分的に満たされました。
14 世紀の終わりから、硝石園は組織的に栽培されました。動物の排泄物(糞、糞便、尿、血液)は、石灰質の土、墓地や食肉処理場、沼地の土、石灰、がれき、灰をピットに詰めたり、積み上げたり、時には液体の肥料や尿を注いだりしていました。 1、2 年後、分解によって大量の硝石が生成され、地球から洗い流すことができました。収量は約 6:1 でした。つまり、6 kg の硝酸土から 1 kg の硝石が得られました。
特別で非常に人気のない職業としての硝石ボイラーは、いつでもプロパティに立ち入り、そこで硝石を探すことが許可されていました。これは、礼拝の時間を除いて、17 世紀と 18 世紀の教会にも当てはまりました。スウェーデンでは、農家は税金の一部を硝石で支払わなければなりませんでした.
19 世紀には、硝酸ナトリウムの巨大な砂漠鉱床 ("Caliche") を独占的に所有するためにチリが近隣諸国に対して行った硝酸戦争さえありました。硝酸カリウム。この変換プロセスは、最終的に 1916 年から、空気と水からアンモニアを生成し、続いて硝酸に変換するハーバー ボッシュ プロセスに置き換えられました。
ソース
<オール>参考文献
- Perry, R.H.、Chemical Engineers' Handbook、第 4 版、McGraw-Hill Book Company、ニューヨーク、1963 年、pp. 9-77
- Janz, GH, et al., Physical Properties Data Compilations Related to Energy Storage II. Molten Salts, NSRDS, April, 1979
- Gartz,J、爆発物の文化史、E.S.Mittler &Son、ハンブルグ、2006 年