| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 全般 | |||||||
| 名前 | 尿素 | ||||||
| 他の名前 |
| ||||||
| 分子式 | CH4 N2 その他 | ||||||
| CAS 番号 | 57-13-6 | ||||||
| 簡単な説明 | アンモニアのようなにおいのある無色の結晶性固体 | ||||||
| プロパティ | |||||||
| モル質量 | 60.06 g mol | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 1.3230g cm | ||||||
| 融点 | 132.5-134.5°C | ||||||
| 沸点 | 130 °C からの分解 | ||||||
| 蒸気圧 | 0.2Pa (75℃) | ||||||
| 溶解度 | 水に易溶:約 1000 g l (20 °C)、エタノールに可溶:50 g l (20 °C)、エーテルおよびクロロホルムに難溶 | ||||||
| 安全上の注意 | |||||||
| |||||||
| WGK | 1 | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
尿素 尿酸と混同しないように、炭酸ジアミドとしても知られる(ラテン尿素)は、窒素化合物(アミノ酸など)の代謝の最終産物として、多くの動物によっていわゆる有機化合物として生成される有機化合物です。尿素サイクルが進行し、尿中に排泄されます。純粋な尿素は白色で結晶性があり、無毒で衛生的な固体で、ほのかなアンモニアのにおいがします。
歴史
尿素は最初に合成された有機化合物でした。 1773年にヒレール・ルーエルによって物質として発見され、1828年にフリードリヒ・ヴェーラーがシアン酸カリウムと硫酸アンモニウムを反応させて初めて人工的に合成した.これは、有機物質は基本的に、いわゆる「visvitalis」を介してのみ生物に見られるという、当時広く普及していた概念と矛盾していました。 (生命力) が作られ、有機化学への道が開かれる可能性があります。
生理学的重要性
尿素はタンパク質とアミノ酸の代謝に由来し、尿中物質に属します. アンモニア (NH3 ) アミノ基から、これらは尿素サイクルの過程で肝臓の非毒性尿素分子に転送されます. これは、腎臓を介して代謝最終産物として排泄されます.
急性または慢性腎不全や糖尿病性腎機能障害などの病気は、血清/血漿中の尿素値の上昇につながる可能性があります.
障害と特殊性: タンパク質の摂取量が多いと、腎機能が正常であっても尿素値が上昇し、腎パラメータが低下します.
アプリケーション
窒素含有量が 46% と高いため、尿素は世界で最も重要な窒素肥料です。尿素はその高い水結合能力のために、化粧品の保湿因子としても頻繁に使用されています.薬局では、尿素は角質溶解剤として知られています。このプロパティは、さまざまなレシピで使用されます。例えば、爪真菌症(爪真菌症)に対する抗真菌剤(抗真菌剤)とともにペースト状に高濃度(40%)に配合されているため、尿素が爪を柔らかくし、感染した爪の物質を少しずつ取り除くことができます.また、アトピー性湿疹や苔癬に対抗するための軟膏の保湿剤としても使用されています.
たばこ製造業者は、たばこに尿素を加えて、pH 値を上げてニコチンをよりよく吸収できるようにします。このようにして、パックのニコチン値が低い軽いたばこが強いたばこになります。
尿素は道路用塩の代用としても使用できます。ただし、コスト上の理由から、これは有益ではありません。
ディーゼルエンジン技術では、排気ガス中の窒素酸化物を減らすために、すすフィルターの後ろで高温の排気流に尿素が噴射されます。消費量は、燃料に対して約 2 ~ 8% です。
安定剤として食品に添加されます。 EU では、指定 E 927b で食品添加物としてリストされています。 砂糖を加えていないチューインガム専用に承認されています。
プロパティ
溶けると尿素が分解し、アンモニア(NH3)が放出されます。 ) ビウレットへ:
工業生産
尿素は工業的に大量に生産され(2004 年:全世界で 1 億 2,700 万トン)、石油などに使用されます。 B. 窒素肥料または NOx として -SNCRプロセスにおける還元剤。天然ガス埋蔵量が多く、かつては単純に燃え尽きていた国では、天然ガスが現在尿素に変換されています。そのために大規模なプラントが使用され、最終的に天然ガス、空気、水から、水素製造→アンモニア製造→尿素合成のプロセスで尿素が製造されます。 CO2 尿素として結合し、大気中に放出されません。最初は溶液の状態である尿素は、顆粒に変換され、袋またはバラで販売されます。世界最大のプラントは、1 日あたり約 4,000 トンの尿素を生産しています。
反応方程式:
-
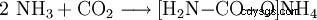
- アンモニアと二酸化炭素が反応して、カルバミン酸アンモニウムを形成します。
-
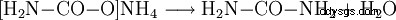
- カルバミン酸アンモニウムが反応して尿素と水を形成します。
尿素の工業的なさらなる用途は、メラミンの生産です。 B. ホルムアルデヒドで処理して合成樹脂、および尿素-ホルムアルデヒド樹脂 (尿素樹脂、いわゆる UF 樹脂) を形成し、 z. B. 合板の生産に使用される.
ソース
<オール>- アドブルー
- 硝酸尿素
- チオ尿素
