| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 2 Na | |||||||
| 全般 | |||||||
| 名前 | 硫酸ナトリウム | ||||||
| 他の名前 | 硫酸二ナトリウム、E 514、グラウバー塩 (Na2 SO4 · 10H2 O) | ||||||
| 分子式 | ナ2 SO4 | ||||||
| CAS 番号 | 7757-82-6 | ||||||
| 簡単な説明 | 無色無臭の結晶 | ||||||
| プロパティ | |||||||
| モル質量 | 142.04 g mol | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 2.70g cm | ||||||
| 融点 | 884 °C | ||||||
| 沸点 | 1689 °C | ||||||
| 溶解度 | 水中で良好:170 g/l、20 °C で | ||||||
| 安全上の注意 | |||||||
| |||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
硫酸ナトリウム (Na2 SO4 、廃止された名前 硫酸ナトリウム ) は硫酸のナトリウム塩であり、2 つの Na カチオン (Na) と硫酸アニオン (SO4 ) 一緒に。十水和物 (Na2 SO4 · 10H2 O) は、化学者ヨハン・ルドルフ・グラウバーにちなんでグラウバーザルツとも呼ばれます カールスバッド塩とも呼ばれます は、カルロヴィ バリのミネラルウォーターを蒸発させることによって得られ、主に硫酸ナトリウム 10 水和物で構成され、グラウバー塩と同様に下剤として使用されます。
歴史
硫酸ナトリウムは、1655年頃、化学者で薬剤師のヨハン・ルドルフ・グラウバーによって製造され、記載されました.彼自身、発見した塩を Sal mirabilis と呼んだ とミラビリ .
取得と表示
硫酸ナトリウムは、硫酸が苛性ソーダで中和される化学工業反応の副産物であることが多いため、天然鉱物から採掘されることはめったにありません。技術的な表現の別の可能性は、岩塩 (NaCl) を硫酸と反応させて、副生成物として硫酸ナトリウムを含む塩酸を得る (800°C) ことです。
-
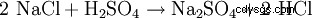
- 塩化ナトリウムと硫酸が反応して、硫酸ナトリウムと塩化水素が形成されます。
硫酸ナトリウムは、実験室で次の反応によって生成できます:
-

- ナトリウムと硫酸が反応して、硫酸ナトリウムと水素が形成されます。
-
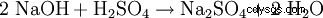
- 苛性ソーダを硫酸で中和すると、硫酸ナトリウムと水が生成されます。
プロパティ
無水硫酸ナトリウムは 884 °C で融解し、吸湿性があり、加熱すると水に容易に溶けます (溶解熱)。対照的に、十水和物は、いわゆるエントロピー効果により、強い冷却下で溶解します。硫酸ナトリウム十水和物は、多くのミネラルウォーターの成分であり、約32°Cから独自の結晶水にゆっくりと溶けます.無水硫酸ナトリウムで過飽和されたこの溶液から無水塩が分離します。
使い方
硫酸ナトリウムは、充填剤としての洗剤、下剤としての医薬品、パルプ製造 (硫酸塩プロセス)、およびガラス、繊維、塗料産業で使用されています。アニールされた無水硫酸ナトリウムは、実験室で有機溶媒を乾燥させるために使用されます。硫酸ナトリウム十水和物 (グラウバー塩 ) は、下剤および潜熱蓄熱材として使用されます。
食品技術では、引き締め剤、酸性度調整剤、担体物質として使用されます. 硫酸ナトリウムと硫酸水素ナトリウムは、EU で E 514 番号が付けられた食品添加物です. 上限なし (満足度 ) 一般に食品用に承認されています。
