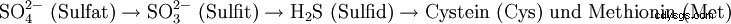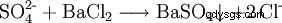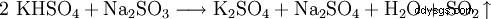| Eigenschaften | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| <表> | |||||||||||||||||||||||||||||||
| <表> | |||||||||||||||||||||||||||||||
2,65 · 10 Pa bei 388 K
{syn.}
{syn.}
95,02 %
0,75%
4,21%
{syn.}
0,02%
{syn.}
{syn.}
{syn.}
{syn.}
| スピン | γ in rad·T·s | E | fL bei B =4.7 T MHz | |
|---|---|---|---|---|
| S | 3/2 | 2,053 | 1,72 · 10 | 7,670 (2,3488 T) |

F
Leichtent-
zündlich
Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen.
シュヴェフェル (chemisch nach dem Lateinischen 硫黄 [ˈzʊlfʊr] または 硫黄 genannt, im Deutschen eventuell vom Indogermanischen *suel- "schwelen" abgeleitet) ist ein chemisches Element der Sauerstoffgruppe. Er verbrennt and der Luft mit blauer Flamme und erzeugt dabei stechend riechendes Schwefeldioxid. Schwefel ist für Lebewesen ein essentielles Element. Er kommt unter anderem in Aminosäuren und Enzymen vor, und spielt eine wichtige Rolle bei der anaeroben Energiegewinnung vieler Mikroorganismen.
変更
Schwefel tritt in verschiedenen Modifikationen auf:
フェスター・シュヴェフェル
- Die bei Raumtemperatur thermodynamisch stabilste Modifikation des Schwefels ist α-Schwefel, rhombisch kristallisierend (rhombischer Schwefel). Er ist geruch- und geschmackslos und hat die typische schwefelgelbe Farbe.
- Bei 95,6 °C liegt der Umwandlungspunkt zu β-Schwefel. Diese Schwefelmodifikation ist fast farblos und kristallisiert monoklin (monokliner Schwefel).
- Seltener ist der ebenfalls monoklin kristallisierende γ-Schwefel (Rosickyit).
フリュシガー シュヴェフェル
- λ-シュヴェーフェル:S8 -Ringe (gelb) (Schwefelblüte)
- π-シュヴェーフェル:Sn (6 ≤ n ≤ 25, n ≠ 8) niedermolekulare und größere Ringe
- μ-Schwefel:Sn (10 ≤ n ≤ 10) hochmolekulare ケッテン
Fester Schwefel besteht normalerweise aus S8 -Molekülen, bei denen acht Schwefel-Atome in einem Ring zick-zack-förmig gebunden sind (sog. Kronenform)。 Beim Erhitzen schmilzt der β-Schwefel, wobei auch andere Ringe (v. a. S6 、S7 、S12 ) 温度で Anteilen auftreten. Bei weiterer Erhöhung der Temperatur brechen die Ringe durch thermische Anregung auf und bilden zunächst lange Ketten (Polymerisation, sog. λ-Ubergang bei ca. 159 °C), diese verkürzen sich durch Zerfall dann bei steigender Temperatur wieder. Neben diesen Schwefelketten liegen aber immer auch S-Ringe vor, im wesentlichen jedoch S8 . Am λ-Übergang ändern sich eine Reihe physicalischer Eigenschaften (z. B. Viskosität, optische Absorption und damit auch die Farbe).Gasförmiger Schwefel ist dunkelrot und besteht anfangs aus S8 -Ringen, die bei höheren Temperaturen dann weiter aufbrechen, so dass die Moleküle immer kleiner werden. Ab etwa 1800 °C hat man dann Schwefelatome.
フォルコメン
Schwefel kommt mit einem Anteil von 0.048 % in der Erdhülle (15. Stelle der Elementhaufigkeit) vor. In der Natur kommt Schwefel elementar in mächtigen Lagerstätten z.B.シジリアン、ポーレン、イラク、イラン、ルイジアナ、テキサス、メキシコで。
Weitverbreitet ist Schwefel in sulfidischen Mineralien, wie Pyrit FeS2 、クプフェルキーズ CuFeS2 、Bleiglanz PbS und Zinkblende ZnS。 Die meisten Metalle (v.a. Schwermetalle) kommen in der Natur als schwerlösliche Sulfide vor.
Auch in Form von Sulfaten, wie Gips (CaSO4 · 2 H2 O)、Schwerspat (BaSO4 ) oder anderen schwer wasserlöslichen Sulfaten kommt Schwefel natürlich vor.
Eine wichtige Quelle für Schwefel sindfosile Brennstoffe wie Erdöl, Erdgas und Kohle. Vor allem Erdgas enthält relativ viel Schwefelwasserstoff (H2) S)。 Es ist darin durch Abbau schwefelhaltiger organischer Stoffe entstanden.
シュヴェフェル als ミネラル
Schwefel tritt gediegen、同様にエレメンタラー形式、別名 Schwefelblüte (ゲルバー・シュヴェフェル ) in der Natur auf. Er kristallisiert unterhalb etwa 95 °C im orthorhombischen Kristallsystem (α-Schwefel), hat eine Dichte von 2,0 bis 2,1, eine Härte von 1,5 bis 2,5 und eine hell- bis dunkelgelbe Farbe, sowie eine weiße Strichfarbe . Meist zeigt er hellgelbe prismen- oder pyramidenförmige Kristalle, die sich auf Gesteinsflächen aus schwefelreichen Gasen durch unvollständige Oxidation von Schwefelwasserstoff (H2 S) or Reduktion von Schwefeldioxid (SO2) )ビルデン。 Oberhalb etwa 95 °C kristallisiert Schwefel monoklin (β-Schwefel)。 Diese Form wandelt sich unterhalb 95 °C rasch in die orthorhombische α-Form um.
Reiner Schwefel ist relativ selten, wird allerdings in großen Mengen bei Vulkanausbrüchen freigesetzt. Er findet sich in Vulkanschloten oder an anderen Postvulkanischen Erscheinungen.Schwefel kommt aber auch in derber Form, das heißt, ohne mit bloßem Auge erkennbare Kristalle vor, insbesondere in Sedimenten or Sedimentgesteinen. Häufig findet er sich in Evaporiten (Salzgesteinen), wo er meistens durch Reduktion von Sulfaten entsteht.
特徴 ミネラル成分が含まれていない場合 シュメルツプンクト 112.8 °C (α-S) ベジーフングスヴァイス 119.2 °C (β-S).Siedepunkt bei 444.7 °C
ゲウィンヌン
Früher bildete das gediegene Mineral eine wichtige Quelle für Schwefel:3,5 Millionen Tonnen wurden jährlich mit Hilfe des von Hermann Frasch entwickelten Frasch-Verfahrens abgebaut, hauptsächlich in den USA und in Polen. Den größten Anteil machte jedoch aus Sulfiderzen gewonnener Schwefel aus:Aus dieser Quelle stammten etwa 50 Millionen Tonnen pro Jahr. Heute fällt der Schwefel in großen Mengen als Abfallprodukt bei der Entschwefelung von Erdöl mit Hilfe des Claus-Verfahrens an.
Biologische Bedeutung
Schwefel は、アミノ酸のシステインとメチオニンに分類されます。 Schwefel ist damit ein essentielles Element lebender Zellen. Disulfidbrückenbindungen sind weit verbreitet und tragen zur Ausbildung und Stabilisierung von Proteinstrukturen bei.
Einige Untergruppen der Proteobakterien sind in der Lage, unter Sauerstoffausschluss Photosynthese zu betreiben. Sie verwenden Schwefelwasserstoff (H2 S) orer elementaren Schwefel an Stelle von Wasser (H2) O) als Elektronendonator für die Reduktion von CO2 、 siehe dazu exemplarisch Thiomargarita namibiensis .
Pflanzen nehmen Schwefel über die Wurzeln in Form von Sulfat-Ionen auf, die dann zu Sulfid reduziert und anschließend zur Bildung von Cystein und anderen organischen Schwefelverbindungen genutzt werden.
プフランツェンのシュヴェフェル同化
Der Schwefel wird als Sulfat über die Wurzeln aufgenommen. Die Assimlation findet zwar auch in den Wurzeln statt, die Hauptmenge des Sulfats wird jedoch uber die Xylemelemente in die Blätter transportiert und dort im Chloroplasten reduziert:
エコロジー アスペクテ
Bei der Energiegewinnung ausfossilen Brennstoffen wie Steinkohle, Braunohle und Erdöl werden große Mengen Schwefeldioxid SO2 フリーゲセット。 Dieses bleibt als Gas oder im Wasser der Wolken gelöst zunächst in der Atmosphäre. Dabei bildet es einen wichtigen Bestandteil des gesundheitsgefährdenden Smogs. Abgebaut werden kann es, indem von Sauerstoff zu Schwefeltrioxid SO3 oxidiert wird und dann als Schwefelsäure H2 SO4 mit dem Regen ausgespült wird. Daraus ergibt sich ein weiteres Problem, da diese als Bestandteils des Sauren Regens zur Versauerung der Böden beiträgt. Seit den 1970er Jahren sind darum Maßnahmen zur Rauchgasentschwefelung in Deutschland gesetzlich vorgeschrieben. Daneben werden seit einigen Jahren die Entschwefelung von Fahrzeugkraftstoffen (vor allem Diesel) forciert. Durch diese Vorschriften und ihre Umsetzungen konnten die Schwefelemissionen seit den 1960er Jahren drastisch reduziert werden. Dies spiegelt sich auch deutlich in der Tatsache wide, dass in der Landwirtschaft die Schwefeldüngung notwendig wird. Dies war zuvor nicht related.
Verwendung
Schwefel wird sowohl in der chemischen Industrie als auch in der pharmazeutischen Industrie genutzt, unter anderem zur Produktion von Schwefelsäure, Farbstoffen, Insektiziden und Kunstdüngern.
Der pharmazeutische Nutzen von Schwefel war bereits im Altertum bekannt. Innerlich wurde Schwefel als Laxans (Abführmittel) eingesetzt. Er reizt die Darmschleimhaut. Der dabei durch Bakterien erzeugte Schwefelwasserstoff regt die Peristaltik an. Außerlich kamen Schwefelrezepturen bei Hauterkrankungen wie Akne, Ekzemen, Krätze, Mykosen u.を。ツム・アインザッツ。 Heute findet Schwefel in der Dermatologie nur noch selten Verwendung, ist aber noch nicht vollständig aus der pharmazeutischen Literatur verschwunden. Nach wie vor gibt es pharmazeutische Zubereitungen, die als Wirk-bzw. Hilfsstoff Schwefel は魅了されます。 In der klassischen Homopathie ist Sulfur eines der so genannten großen Mittel .
In der Schwerindustrie ist Schwefel als Legierungselement für Stahl bedeutend. Automatenstähle sind oft schwefellegiert, da Schwefel zu erhöhtem Spanbruch führt.
Schwefel findet auch bei der Herstellung von Schwarzpulver, als Salpeterschwefel in der Feuerwerkerei, orer bei anderen Explosivstoffen Verwendung.
Schwefelverbindungen
硫化物
- シュヴェフェルワッサーストフ
- 硫化物、ジンノーバー (HgS)
- ワッサーストフペルスルフィド
酸化物
- Schwefeloxide, wie Schwefeldioxid und Schwefeltrioxid,
ザウアーストフサウレンとサルツェ
| Säuren des Typus H2 SOn | ||||
|---|---|---|---|---|
| Oxidationsstufe des Schwefels | 構造 | サウレン | サルゼ | ベイシュピーレ |
| +II | スルホキシル酸 H2 SO2 | スルホキシレート | ||
| +IV | Schweflige Säure H2 SO3 | 亜硫酸塩 |
| |
| +VI | Schwefelsäure H2 SO4 | 硫酸塩 |
| |
| +VI | Peroxo(mono)schwefelsäure H2 SO5 | ペルオキソ硫酸 |
| |
| Säuren des Typus H2 S2 On | ||||
|---|---|---|---|---|
| ミトルレ Oxidationsstufe des Schwefels | 構造 | サウレン | サルゼ | ベイシュピーレ |
| +私 | Thioschwefelige Säure H2 S2 O2 | チオ亜硫酸塩 (unbekannt) | ||
| +II | Thioschwefelsäure H2 S2 O3 | チオ硫酸塩 |
| |
| +III | ディチオニゲ サウレ H2 S2 O4 | 亜ジチオン酸塩 |
| |
| +IV | Dischweflige Säure H2 S2 O5 | 二亜硫酸塩 |
| |
| +V | Dithionsäure H2 S2 O6 | ジチオン酸 |
| |
| +VI | Dischwefelsäure H2 S2 O7 | 二硫酸塩 | ||
| +VI | Peroxodischwefelsäure H2 S2 O8 | ペルオキソ二硫酸塩 |
| |
窒化物
- シュヴェフェル窒化物:S4 N4 、S2 N2 und (SN)x
ハロゲン化物
- シュヴェフェルハロゲン化物:z. B. Schwefeldichlorid、Schwefeltetrachlorid、Dischwefeldichlorid und höhere Oligosulfanchloride (Vulkanisierung)
Organoschwefelverbindung
In zahlreichen organischen Verbindungen kommt Schwefel gebunden vor und wird unter Organoschwefelverbindung ausführlicher beschrieben.
- チオール (=メルカプタン)
- チオエーテル
- Heterocyclische Verbindungen, wie Thiophen
- スルホキシド wie ジメチルスルホキシド als Lösungsmittel
- スルホン
- Sulfonsäuren, deren Salze, die Sulfonate, zum Beispiel als Tenside dienen
ナクヴァイス
Es existieren verschiedene Nachweisreaktionen für Schwefel. Schwefel wird in Verbindungen nach Reduktion durch elementares Natrium in Natriumsulfid überführt. Sulfid-Anionen weist man mit Blei-II-salzlösungen nach, wobei ein schwarzer Niederschlag von Blei-II-sulfid entsteht:
Beim Ansäuern von festen, また ungelösten Sulfiden entsteht zudem ein charakteristischer Geruch, nach faulen Eiern (Verdrängungsreaktion, Vorsicht:Das Gas Schwefelwasserstoff ist giftig; Einatmen vermeiden, Abzug!). Auch dieses Gas schwärzt Bleiaacetatpapier.
Durch Oxidation schwefelhaltiger Verbindungen entstehen Sulfit und Sulfat. Letzteres weist man mit Barium-II-salzlösungen nach:Es entsteht ein weißer Niederschlag von Bariumsulfat:
Kaliumhydrogensulfat nachgewiesen の亜硫酸塩。 Beim Verreiben der auf Sulfit zu prüfenden Substanz mit Kaliumhydrogensulfat entsteht das stechend riechende Schwefeldioxid. Für Natriumsulfit ergibt sich folgende Reaktiongleichung:
トリビア
- Bei den mittelalterlichen Alchemisten symbolisierte der Löwe den Schwefel
- Nicht nur in der deutschen Literatur wird der Geruch von Schwefel meist mit dem Erscheinen des Teufels assoziiert, bzw. kündigt Schwefelgeruch den Teufel an (vgl. auch die Rede von Hugo Chavez vor der UNO).
クエレン
<オール>- 鉱物体系
- Liste der Minerale
文学
- R. Steudel (Hrsg.):元素硫黄および硫黄に富む化合物 (パート I &II). In:現在の化学のトピック。 巻。 230 &231、シュプリンガー、ベルリン 2003
| H | 彼 | ||||||||||||||||||||||||||||||
| リー | Be | B | C | N | O | F | ねえ | ||||||||||||||||||||||||
| ナ | Mg | アル | シ | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | カルシウム | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | ガ | げ | As | セ | Br | Kr | ||||||||||||||
| Rb | Sr | Y | Zr | Nb | 月 | Tc | Ru | Rh | Pd | Ag | Cd | 中 | Sn | Sb | テ | 私 | Xe | ||||||||||||||
| Cs | バ | ラ | Ce | Pr | Nd | 午後 | Sm | Eu | Gd | Tb | ダイ | ホー | えっと | Tm | Yb | Lu | Hf | た | W | 赤 | Os | Ir | ポイント | 金 | Hg | Tl | Pb | Bi | ポー | で | Rn |
| フランス | Ra | Ac | Th | パ | U | Np | プゥ | 午前 | Cm | Bk | 参照 | エス | Fm | Md | いいえ | Lr | Rf | Db | Sg | Bh | Hs | 山 | D | Rg | Uub | ウット | Uuq | ウアップ | うーん | Uus | ウーオ |
| アルカリ金属 | エルダルカリメタル | ランタノイド | アクチノイド | ユーベルガングスメタル | メタル | ハーフメタル | ニヒトメタル | ハロゲン | エーデルガーゼ |