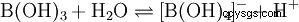| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 全般 | |||||||
| 名前 | ホウ酸 | ||||||
| 他の名前 | ボロファックス | ||||||
| 分子式 | H3 BO3 | ||||||
| CAS 番号 | 10043-35-3 | ||||||
| 簡単な説明 | 白い粉 | ||||||
| プロパティ | |||||||
| モル質量 | 61.83 g/mol | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 1.44g/cm | ||||||
| 融点 | 185°Cで分解 | ||||||
| 沸点 | 存在しません | ||||||
| 蒸気圧 | 2.7 hPa (20 °C) | ||||||
| 溶解度 | 水中 50 g/l | ||||||
| 安全上の注意 | |||||||
| |||||||
| MAK | なし | ||||||
| LD50 | 2660mg/kg | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
ホウ酸 (また:オルトホウ酸 )、H3 BO3 、ホウ素の最も単純な酸素酸であり、その塩はホウ酸塩と呼ばれます。 (以前は水酸化ホウ素とも呼ばれていました)
プロパティ
純粋なホウ酸は、融点が 171 °C のうろこ状で無色の光沢のある結晶を形成します。最初は水に溶けにくいですが、このプロセスは濃度が高くなるにつれて加速します。溶液は弱酸性に反応します。揮発性のホウ酸メチルエステルは、濃硫酸がなくてもメタノールで形成され、緑色の炎で燃焼し、定性的なホウ素検出に使用されます。
オルトホウ酸が加熱されると、水が分離され、いくつかの変形で発生するメタホウ酸 HBO
水素原子が 3 つあるにもかかわらず、ホウ酸は水中で一塩基酸のように反応し、テトラヒドロキソホウ酸イオン B(OH)4 を生成します。 .ここでは、プロトン供与体としてのブレンステッド酸のようには振る舞いませんが、水酸化物受容体としてのルイス酸のように振る舞います:
ホウ酸は非常に弱い酸です (pK
この反応は、ホウ酸のアルカリ滴定に使用され、窒素のケルダール測定にも使用されます. 少量では毒性がありません.しかし、ボランは非常に有毒です。
発生と抽出
遊離ホウ酸は、イタリア中部トスカーナの蒸気源 (噴気孔) に見られます. 酸はこれらの源から光沢のある小板に蒸発させることによって得ることができます.ホウ酸はトスカーナでもミネラル サッソリンとして産出されます。ただし、鉱物ケルナイト Na2 などのアルカリおよびアルカリ土類塩は非常に重要です。 B4 O7 · 4H2 O. 同様の、より希少な鉱物はホウ砂で、これには 8 または 10 等量の結晶水が含まれています。しかし、今日では、これは主に kernit から取得されます。ホウ砂を塩酸または硫酸で処理すると、ホウ酸 B(OH)3
使い方
水溶液 (「ボアウォーター」) は穏やかな消毒剤として機能し、防腐剤 E284 としても承認されています。ホウ酸は、ホウケイ酸ガラス、磁器、エナメルの製造に使用される中間体であり、難燃剤や媒染剤にも含まれています。ホウ酸の世界の年間生産量は 200 キロトン以上です。
ホウ酸の別の用途は、加圧水型原子炉を備えた原子力発電所です。そこでは、天然のホウ素に 20% 存在する同位体 B-10 の熱中性子に対する吸収係数が高いため、ホウ酸が使用され、増倍率 k を制御し、原子炉の出力を制御します。
さらに、ホウ酸は CO2 の計算に使用されます。 ・太古の地球で使われていた給料。酸性環境では、より多くのホウ素がホウ酸に取り込まれます。 pH がアルカリ性に変化すると、ホウ酸はホウ酸の塩であるホウ酸塩に変換されます。有孔虫 (化石および最近の単細胞生物) は殻を構築するためにホウ酸塩を必要とするため、この関係を使用して、地球の歴史のどの時点でこの地域にどの pH が存在したかを判断できます。このような原生動物の殻やムール貝などは海洋堆積物の主要部分を構成するため、そこから堆積物コアを簡単に採取し、実験室で 2 つのホウ素同位体を調べることができます。このような結果は、氷のコアに閉じ込められた気泡とよく相関していました。
ホウ酸とメタノールを組み合わせると、緑色の炎の色が生成されます。他のアルカノールと関連して、緑の炎の境界線。このプロパティは、火のショーでよく使用されます。たとえば、炎の棒、ポア、または火の鉢に色を付けるために使用されます。