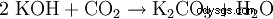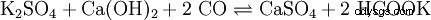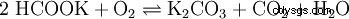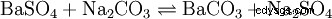| 構造体 | |||||||
|---|---|---|---|---|---|---|---|
| 2 K | |||||||
| Allgemeines | |||||||
| 名前 | 炭酸カリウム | ||||||
| アンデレ・ナメン |
| ||||||
| Summenformel | K | ||||||
| CAS 番号 | 584-08-7 | ||||||
| クルツベシュライブン | ヴァイセ、クリスタリン パルバー | ||||||
| 固有値 | |||||||
| モル質量 | 138,20 g·mol | ||||||
| 集合体 | 祭り | ||||||
| ディヒテ | 2,428 g·cm | ||||||
| シュメルツプンクト | 891 °C | ||||||
| シーデプンクト | ゼルセッツン | ||||||
| Löslichkeit | ワッサー (1120 g/l) 中の sehr ガット、アルコール中の unlöslich | ||||||
| Sicherheitshinweise | |||||||
| |||||||
| MAK | ケイネ・マック | ||||||
| WGK | 1 | ||||||
| SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||
炭酸カリウム (ポッタシェ )、K
ヴァーハルテン
In Wasser ist es sehr leicht und Gut löslich (1120 g/l)。 Durch Hydrolyse reagiert die Lösung wegen der Bildung von Kaliumhydrooxid Catholicsch:
-
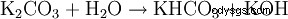 .
. - Kaliumcarbonat reagiert mit Wasser zu Kaliumhydrogencarbonat und Kaliumhydrooxid.
Mit Säuren entstehen unter Kohlendioxidentwicklung die entsprechenden Kaliumsalze. Bei Raumtemperatur kristallisiert es als Dihydrat aus der wässrigen Lösung.
フォルコメン
- in einigen Binnengewässern (Totes Meer, Wüste Lop Nor)
- in einigen kleineren Lagerstätten
ゲウィンヌン
炭酸カリウムは、炭酸水素ナトリウム (KHCO3 ) zu gut löslich ist.
- Carbonisierung von Kalilauge:
- Als CO2 -Quelle nutzt man überwiegend Verbrennungsgase.
- Kaliumsulfat und Kohlenmonoxid bei 30 bar (Formiatverfahren). Das abgetrennte Kaliumformiat wird anschließend oxidativ calciniert:
- Auslaugen von Pflanzenasche und anschließendes Eindampfen (historisch, technisch keine Bedeutung mehr)
Verwendung
- Herstellung von Schmierseifen
- Düngemittel für saure Böden
- Herstellung von Kaligläsern
- Herstellung von Farben
- Herstellung von fotografischen Entwicklern
- wasserfreies Kaliumcarbonat wird im Laborbereich auch als Trocknungsmittel eingesetzt.
- Triebmittel für Flachgebäck (“Plätzchen”, besonders Weihnachtsbäckerei) und Teigen mit hohem Zuckergehalt.
- Behandlung von Kakao
- Neutralisationsmittel bei der Verwendung von Salzsäure (E 507) als 'Aromaverstärker'.
- Schnelltrocknung von Rosinen:Durch Entfernen der natürlichen Wachsschicht der Trauben verdunstet die Feuchtigkeit leichter.
- als Ausgangsprodukt für andere Kaliumverbindungen.
- Zum Entfernen von Asche aus Töpfen (1 Essl. auf die Kruste im Topf geben, über Nacht stehen lassen und am nächsten Tag mit einer Tasse Wasser aufkochen:die Rückstände lösen sich flockig vom Topfboden)
- Trennmittel für Gipsabgüsse (Bildhauerei)
- Schmelzcarbonatbrennstoffzellen の Elektrolytbestandteil
- Zusatzstoff für die Einnahme von bestimmten Doestmitteln
ソーダ・ポッタシェ・アウフシュルス
Der Soda-Pottasche-Aufschluss wird für schwerlösliche (Erdalkali-)Sulfate, hochgeglühte (saure oder amphotere) Oxide, Silicate und Ag-Halogenide verwendet; der Aufschluss findet in einer Na2 CO3 /K
Ein Beispiel für Sulfate: