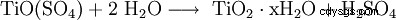| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 構造式がありません | |||||||
| 全般 | |||||||
| 名前 | 酸化チタン(IV) | ||||||
| 他の名前 |
| ||||||
| 分子式 | O2 ティ | ||||||
| CAS 番号 | 13463-67-7 | ||||||
| 簡単な説明 | 白い結晶性粉末 | ||||||
| プロパティ | |||||||
| モル質量 | 79.90 g mol | ||||||
| 物質の状態 | 修正済み | ||||||
| 密度 | 4.24g cm | ||||||
| 融点 | 1855℃ | ||||||
| 沸点 | 2900°C | ||||||
| 溶解度 | フッ化水素酸、濃硝酸、濃硫酸に不溶、水、塩酸、希硝酸、希硫酸に不溶 | ||||||
| 安全上の注意 | |||||||
| |||||||
| 熱力学的特性 | |||||||
| ΔHf | −249 kJ/mol (ルチル) | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
酸化チタン(IV) (二酸化チタン ) は、チタンの酸化物の 1 つです。
オカレンス
酸化チタン (IV) は、3 つの修飾で自然に生成されます:
- ルチルは、主に角柱状の晶癖を持つ正方晶の鉱物です。 ルチルという名前 ラテン語の rutilus に由来 – 赤みを帯びた。ルチルの密度は 4.26 g/cm です。白色顔料として特に人気があります。
- アナターゼは、正方晶の全面体結晶を形成します (正方体は、結晶系内で最も対称なグループを意味し、正方晶では 4/m 2/m 2/m となります)。アナターゼは徐々に (700 °C 以上の温度からより急速に) 不可逆的にルチルに変化します。アナターゼの密度は 3.88 g/cm です。アナターゼは白色顔料としても機能します。
- ブルカイトは斜方晶系の鉱物を形成し、白色顔料としては機能しません。ブルカイトも融点以下でルチルに変わります。
自然の堆積物には不穏な色があるため、z。 B. イルメナイト中の鉄 (FeTiO3 ) が生じた場合、これらは硫酸法または塩化物法 (推奨) で精製されます。
取得と表示
Ti(IV)化合物の加溶媒分解 (加水分解):
プロパティ
二酸化チタンの融点は 1855 °C です。熱安定性と耐久性に優れ、屈折率が高く (2.8)、優れた着色力と隠蔽力を備えています。二酸化チタンは化学的に非常に不活性です。耐光性があり、安価で、完全に無毒であるため、最も重要な白色顔料です。
使い方
二酸化チタンは白色の着色剤として使用されています。 1908年にノルウェーとアメリカで発見され、1909年からKronos Titanium Whiteという名前で製造されました。 1924 年に Degea-Titanweiß という名前でドイツで生産が開始されました。チタン ホワイトは 1938 年までアナターゼ型でのみ生産されていましたが、その後は主にルチル型で生産され、油結合剤や有機染料に対してより安定であることが証明されました。そのため、ルチル ホワイトとも呼ばれていました。
チタンホワイトは、すべての白色顔料の中で最高の不透明度と優れた明度を備えています。化学的に安定しており、毒性がなく、E 171 という名称で歯磨き粉や咳止めドロップなどの食品添加物として使用されています。油絵に使われることもあります。技術分野では、塗料やワニス(壁の塗料や布地など)、紙、日焼け止めクリームの紫外線遮断剤、医薬品(錠剤)の光沢剤として使用されています。 TiO2の光触媒効果 ナノ粒子は、「自己洗浄」表面 (光触媒自己洗浄) の UV 活動に関連して使用されます。色素太陽電池 (グレッツェル電池) もまた、二酸化チタンの半導体特性に基づいています。二酸化チタンは、クラス 1 セラミック コンデンサのセラミック誘電体の主成分としても使用されます。
アナターゼ修飾の二酸化チタンは、SCR プロセスを使用した煙道ガスの産業用脱窒に使用される触媒の主成分です。
硫酸法による酸化チタンの製造では希酸(希硫酸)が生成され、その一部は濃縮して酸化チタンの製造に再利用されます。一部の国では、この希酸の一部が今でも川や海に排出されたり、投棄されたりしていますが、塩化物プロセスでは希酸はまったく生成されません。使用された塩素の大部分はプロセス サイクルに残ります。
TiO2 タイル仕上げの分野でも使用されます。つまり、処理されたタイルの表面が汚れにくくなります。
証明
寒さの中で新たに沈殿した二酸化チタンは両性であり、希鉱酸に溶けます。消化は、磁器製るつぼで硫酸水素カリウムを使用して行われます。次に、少量の硫酸を加えた冷水に溶かします。過酸化水素を数滴加えると、黄色(塩基性)から黄橙色(酸性、写真)[Ti(O2 ) aq] カチオン. 塩酸と亜鉛 (顆粒) は発生期の水素を形成し、これが Ti(IV) を赤紫色 [Ti(H2] O)6 ] 削減。
ナノテクノロジー