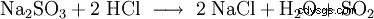| 構造式 | |||||||
|---|---|---|---|---|---|---|---|
| 全般 | |||||||
| 名前 | 二酸化硫黄 | ||||||
| 他の名前 | 硫黄(IV)酸化物、無水硫黄 | ||||||
| 分子式 | SO2 | ||||||
| CAS 番号 | 7446-09-5 | ||||||
| 簡単な説明 | 無色、刺激性、有毒ガス | ||||||
| プロパティ | |||||||
| モル質量 | 64.06 g mol | ||||||
| 物質の状態 | 気体 | ||||||
| 密度 | 2.73 kg m (1 バール、15°C) | ||||||
| 融点 | −75 °C | ||||||
| 沸点 | −10 °C | ||||||
| 蒸気圧 | 3.3 バー (21°C) | ||||||
| 溶解度 | 水中で良好 (112 g/l ) | ||||||
| 安全上の注意 | |||||||
| |||||||
| MAK | 1.3mg m | ||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | |||||||
二酸化硫黄 、SO2 、亜硫酸H2の無水物 SO3 .二酸化硫黄は、刺激臭と酸味のある無色の有毒ガスです。それは主に、最大 4% の硫黄を含む石炭や石油製品などの硫黄含有化石燃料が燃焼するときに生成されます。その結果、二酸化硫黄がまず酸素によって酸化されて三酸化硫黄になり、次に水によって硫酸(H
製造
- 硫黄または硫化水素を燃焼させる
- 硫化鉱を焙煎することにより
例えばB.黄鉄鉱:
-

- 二硫化鉄(II)と酸素が反応して、酸化鉄(III)と二酸化硫黄を形成します。
- より強い酸による亜硫酸塩から
プロパティ
| E 番号 | 220 |
| 臨界温度 | 157.5℃ |
| 臨界圧力 | 7.9 バー |
二酸化硫黄のメソメリック極限式は次のとおりです:
一般的な用語:
液体二酸化硫黄は多くの物質を溶解するため、貴重な溶媒としての地位を確立しています.
使い方
二酸化硫黄は、E 220 という名前で食品業界で使用されています。 特にドライ フルーツ、ポテト料理、フルーツ ジュース、ジャム、ワインの防腐剤および酸化防止剤として使用されます. また、塩化スルフリル SO2 の生成にも使用されます Cl2 および塩化チオニル SOCl2 .
さらに、二酸化硫黄は、三酸化硫黄を製造するための重要な出発原料であり、濃硫酸、例えば硫酸塩を製造します。 B. 連絡方法で。
二酸化硫黄は、多くの化学薬品、医薬品、染料の製造、紙や織物の漂白にも使用されます.
汚染
高濃度の SO2 は、人間、動物、植物に損害を与えます。酸化生成物は、森林や湖などの敏感な生態系を危険にさらし、建物や材料を攻撃する「酸性雨」をもたらします。
先進工業国では、低硫黄または無硫黄の可燃物と燃料を使用することで、過去 20 年間に総 SO2 排出量が大幅に削減されました。
安全上の注意
MAK 値を超える二酸化硫黄濃度は、人間に頭痛、吐き気、眠気を引き起こす可能性があります。より高い濃度では、ガスは気管支や肺、さらには核酸、遺伝特性のキャリアに深刻な損傷を与えます.