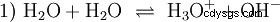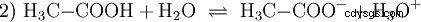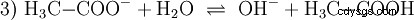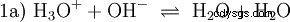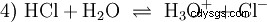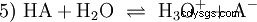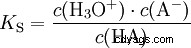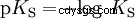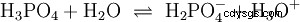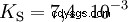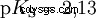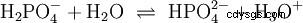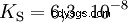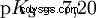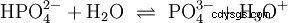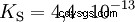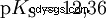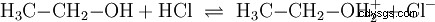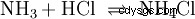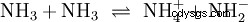酸 狭義では、プロトン (H) を反応パートナーに移動できるすべての化合物です。これらはプロトン供与体として機能します。水溶液では、反応物は本質的に水です。オキソニウムイオン (H3 O)、溶液のpHはこうして低下する。酸はいわゆる塩基と反応して、水と塩を形成します。したがって、塩基は酸の反対であり、中和することができます。
より広い意味では、さまざまな酸塩基の概念が、上記の反応をはるかに超える可能性のある、より広範な一連の化学反応を記述しています。
酸の歴史的発展
おそらく最も古い既知の酸 (lat. acidum) ) は酢 (lat. acetum) です。 )、化合物酢酸の約 5% 水溶液。酸は酢のようなものだった (オキソ またはアシダス )。錬金術では、酸は原始物質と見なされていました .酸性特性は、単一の尿酸に基づいていました 、さまざまな物質で有効になりました。酸は石灰や炭酸塩を泡立たせ、腐食作用と焦げたような味をもたらします。酢やその他の植物ジュースを除けば、酸は 13 世紀の終わりまで知られていませんでした。酸に関する広範な知識は、8 世紀に生きた Geber に帰せられましたが、それはもっと若い、いわゆる疑似 Geber による著作に基づいています。 [1]。さまざまな無機酸に関する知識が開発されました。これらはすべて水の種類です。 帰属されました。 18世紀から、それらは鉱酸と呼ばれていました.
- 硝酸 (HNO3 ) はおそらく 13 世紀以降、疑似贈与者によって溶解水 (aqua dissolutiva) として使用されました。 ) または強い水 (アクア フォーティス) ) 説明された。銅のビトリオールは、硝石とミョウバンで赤熱するまで加熱されました。亜硝酸ガスが逃げ、水と硝酸を形成します。この酸は分離水とも呼ばれていました 、化学反応で銀を溶解しますが、金は溶解しません。 1648 年、J. R. グラウバーは、濃縮 (発煙) 硝酸 (スピリタス アシダス ニトリ) の製造について説明しました。 )硫酸との反応による。
- 王水は、硝酸とよく知られているサル アンモニアを反応させることで比較的簡単に得られるため、今日の観点からすると、硝酸と塩酸の混合物であることがおそらく早くから知られていました。王水はすべての酸の女王でした 、金でさえありません、金属の王様 、抵抗できました。
- 亜硫酸 (H2 SO3 )は、元素硫黄を燃焼させることによって得られるため、確かに長い間知られていました.硫酸は確かに多くのプロセスにも存在していました.硫酸 (H2 SO4 ) は、1597 年に A. Libavius によって最初に詳細に説明されました:a) 硝子体 (Oleum vitrioli 、発煙硫酸) および b) 硫黄の燃焼とその後の酸化により希薄な溶液が生成される (Oleum sulphuris) ) 導いた。技術的な実装は、鉛チャンバー プロセスで 19 世紀に成功しました。
- 独立した化合物としての塩酸 (HCl) が知られるようになったのは、16 世紀の終わりになってからです。 A. リバビウスは、食塩と粘土の混合物を点火することによる合成について説明しました。 B. Valentinus は、ビトリオールと食塩を アクア コースティカ に変換したと説明しています。 、腐食性の水。 17 世紀の J. R. グラウバーによる集中的な調査により、グラウバーの塩の幽霊が生まれました。 (Spiritus salis Faithrianus ) 非常に集中した、いわゆる喫煙 塩酸または塩化水素ガス。
酸の現象学的対応物として重要な用語である塩基は、17 世紀に G. E. スタール、R. ボイル、GF ルーエルなどの錬金術師によって使用されました。「塩基性」物質は不揮発性 揮発性酸の固定の根拠 形成され、酸の (腐食) 効果を中和することができます。 A. L. Lavoisier は、特定の化合物に特定の特性を割り当て、18 世紀に化学の基本的な一歩を踏み出しました。彼は、酸は常に非金属酸化物と水から形成され、塩基は金属酸化物と水から形成されると考えていました。一方、J. von Liebig は、酸を、金属によって塩に変換できる水素化合物と見なしていました。
1887 年、S. アレニウスは、水に溶解するとプロトン (H) を放出する物質を酸、水に溶解すると水酸化物イオン (OH) を放出する物質を塩基と定義しました。酸と塩基が結合すると、互いに中和して水になります。しかし、酸素を含まない化合物が含まれていなかったため、理論はまだ不十分でした.アンモニアも酸を中和します. 1923 年、J. N. Brønsted と T. Lowry は、今日でもなお最も重要な酸と塩基の定義を説明しました。それらは、以下の酸の説明の基礎を形成します.
酸の性質
- 酸は特に卑金属と石灰を攻撃します。しかし、衣服、皮膚、目 (一般的にはすべて有機物) も、接触すると危険にさらされます。注意!化学熱傷は常に発生する可能性があります。安全メガネを着用してください!
- 強酸と弱酸があります。塩酸は強酸です。酢酸は弱酸、炭酸は弱酸です。
- 酸は水で希釈できますが、希釈すると効果が著しく弱くなります。濃酸の希釈は発熱反応です。大量の熱が発生し、酸性溶液が制御不能に噴出する可能性があります。したがって、希釈するときは、酸を水に加えるというルールが適用され、その逆ではありません。 「
- 酸が常に液体であるというのはよくある嘘です。純粋に固体として存在する酸のよく知られた代表は、ビタミン C とクエン酸です。
- 酸は青いリトマス紙を赤くします。
- 「酸の反対者」は塩基です (塩基溶液 =灰汁)。それらは酸を中和することができます。塩基は腐食性でもあり、必ずしも酸と反応しない他の多くの物質を攻撃します。
- 酸は、水に溶けると電気を伝導します。ここで、電気分解が起こり、陰極(-極)で水素が形成され、陽極(+極)で酸残基イオン(酸アニオン)の中和物質が形成されます。塩酸。還元 (電子の受容) は陰極で発生し、酸化 (電子の損失) は陽極で発生します。
酸とは?
さまざまな酸塩基の概念について詳しく説明することなく 可能性のある一般的な物事の見方は、ここで紹介として説明する必要があります。 通常は酸と密接に関連しています 多くの場合、明示的な言及なし 水の存在と特定の特性。純水は自己プロトリシスとして知られている現象を受けます。オキソニウムイオン (H
この水の反応式は、酸の性質、つまり H
酸は、特定の方法で水と相互作用できる化合物です。水素原子がイオンのように結合しています (イオノゲン)。これが純粋な酢酸 (H3 C-COOH) が水と結合し、さらに H3 を形成する Oイオン。このような反応が起こると、化合物は酸と呼ばれることがあります。オキソニウムイオンに加えて、酢酸アニオン H3 も形成されます。 C-COO:
酢酸はカルボン酸であり、塩酸などの無機酸に比べてやや弱い酸です。水溶液中では、分子の大部分が解離せずに H
さらに、基本的な反応 これは、酢酸ナトリウムが純粋な状態の場合に発生します 水が溶ける:
ここで水酸化物イオン (OH) が形成されます。この酢酸溶液に適量の酢酸水溶液を加えると溶液は中性になります . H3 の間に立っています O と OH は、最初に水の基本的な特性として提示され、式 (1a) の反転として表される平衡 (1) に入ります。
| 酸は、水溶液 H3 で能力を持つ化合物として理解することができます O-イオンを形成するか、OH-イオンを水分子に変換します。 を形成する能力があります。 O to H2 O. |
酸と呼ばれる多くの物質は、もともと水溶液であり、水素原子がイオン結合した化合物とは容易に理解できません。塩酸は水溶液です 塩化水素 (HCl) のガスであり、強酸と見なされます。この解では、酸を実際に使用する前に、平衡 (4) がすでに存在し、平衡はほぼ完全に右側にあります。
塩化水素は、酸と H3 である可能性を使い果たして久しい。 Oイオンが形成されました。塩酸の実用化により生じる化学的効果は、H3 の反応によるものです。 Oイオンによるものです。酸はH3 Oイオン。ここでの pH 値は酸性度 (濃度) の尺度ですが、酢酸などの弱酸の場合、酸強度の尺度である pKa 値は前景にあります。強酸と弱酸は、H3 に「似ている」または「似ていない」傾向が異なります 水中でOイオンを作る。酸塩基平衡セクションでは、これらの傾向について詳しく説明します。
| 酸の実際の使用における化学的効果は、ほとんどが H3 にある Oイオンバック。オキソニウムイオンは最も重要な酸と考えることができます. |
酸塩基バランス
プロトリシスの間、反応物 (通常は水) は、酸によって放出されたプロトンを吸収します。これは、電子移動が起こるレドックス反応とは区別されます。
水溶液中の酸性HAの一般平衡反応 です:
酸は、H イオンを水に移動する傾向が異なります。これは酸の強さと呼ばれます K 酸反応の平衡定数(酸定数)を表し、示します。酸度定数は多くの場合、pK の形で与えられます。 -値、酸度定数の負の対数として定義されます。
大文字 K の酸 -値 (小さい pK -値) は強酸です。酸を含む溶液の pH が pK より 2 単位低い場合 値、H3 の 100 分の 1 のみ Oイオンが形成されました。
多塩基酸
複数の陽子を分離できる酸は、多塩基酸と呼ばれます .硫酸 (H2 SO4 ) は、二プロトン性 (二プロトン性) リン酸 (H3 PO4 ) トリプロトン (またトリプロトン) 酸。個々のプロトンを放出しようとする試み (プロトリシス) はサイズが異なり、酸定数 (K
リン酸の場合:
pKS -重要な酸の値
水を使わない酸塩基反応
水溶液中で水が関与して起こる酸塩基反応と同様に、他の媒体でも反応があります。無水エタノールでは、エタノールが塩基の役割を果たす塩化水素との反応が起こります。
気相では、ガスのアンモニアと塩化水素が反応して塩化アンモニウム塩を形成します。
水に加えて、他の十分に極性のある溶媒も酸塩基反応の反応物として機能します。良い例は、液体アンモニアの自己プロトン分解です:
酸の例
重要な酸は:
- 硫酸:H2 SO4 (産業用、酸性雨)
- 塩酸:HCl (工業用)
- リン酸:H3 PO4 (コーラ、遺伝物質を含む食品産業)
- 炭酸:H2 CO3 (食品産業、技術、雰囲気)
- 酢酸:CH3 COOH (食品産業)
- フッ化水素酸:HF (コンピューター チップの製造)
- 硝酸:HNO3 (産業用)
多塩基酸の塩は酸としても機能します (「酸性塩」)。たとえば、
- 重硫酸塩
- リン酸水素
参考文献
酸の歴史的発展:
- Claus Priesner, Karin Figala:錬金術:密閉科学の百科事典 ベック、ミュンヘン、1998 年、ISBN 3406441068
- V. Karpenko、J.A. Norris:化学史における Vitriol。 Chem. Listy、Vol. 96、2002、ページ:997-1005 [2]
- 寄付者 ブリタニカで
- 酸のリスト
- 拠点
- 酸塩基の概念