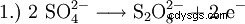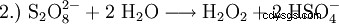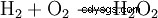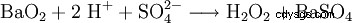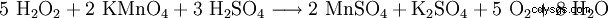| 構造式 | ||||||||
|---|---|---|---|---|---|---|---|---|
| 全般 | ||||||||
| 名前 | 過酸化水素 | |||||||
| 他の名前 | μ-1κO,2κO'-dioxidedihydrogen、perhydrol、過酸化水素 (廃止) | |||||||
| 分子式 | H2 O2 | |||||||
| CAS 番号 | 7722-84-1 (水溶液) | |||||||
| 簡単な説明 | 無色の液体 | |||||||
| プロパティ | ||||||||
| モル質量 | 34.02 g mol | |||||||
| 物質の状態 | 液体 | |||||||
| 密度 | 1.45 g cm (20 °C、純粋) 1.11 g cm (20 °C、30%) | |||||||
| 融点 | −0.41 °C (純粋) −33 °C (35%) −11 °C (90%) | |||||||
| 沸点 | 150.2 °C (ニート) 108 °C (35%) 142 °C (90%, 分解あり) | |||||||
| 蒸気圧 | 1.9hPa (20°C) | |||||||
| 溶解度 | 水と完全に混和する | |||||||
| 安全上の注意 | ||||||||
| ||||||||
| MAK | 0.5 ml m または 0.71 mg m | |||||||
| 可能かつ一般的な場合、SI 単位が使用されます。特に明記しない限り、与えられたデータは標準的な条件下で適用されます。 | ||||||||
過酸化水素 (H2 O2 ) は、水素と酸素のほぼ安定した淡青色の液体化合物で、希釈すると無色になります。それは水よりわずかに粘性が高く、弱酸であり、ほとんどの物質に対して非常に強力な酸化剤です。 B. 銅、真鍮、ヨウ化カリウムが反応し、強力な漂白剤および消毒剤として機能します。高度に濃縮された形で、単一のロケット推進剤としてもコンポーネント ロケット推進剤としても使用できます。
物理的特性
H2 O2 ・分子が曲がっている(二面角=111°)。純粋な過酸化水素は、水素結合による架橋が強いため、非常に粘性があります。高濃度(=ほぼ無水)H2なので O2 特に金属と接触すると、不安定で自然に分解して爆発します。通常、最大 35% の水溶液として店頭で販売されています。ただし、産業用には、50% H2 の濃度もあります。 O2
20% 以上の過酸化水素溶液に触れると、化学火傷を引き起こす可能性があります。したがって、取り扱い時には保護手袋を着用する必要があります。
製造
過去には、過酸化水素は主に硫酸の電気分解によって製造されていました。これによりペルオキソ二硫酸が形成され、その後加水分解されて硫酸と過酸化水素になります。
今日、過酸化水素はアントラキノン法を使用して技術的に製造されています。この目的のために、アントラヒドロキノンを圧力下で大気中の酸素と反応させて、過酸化水素とアントラキノンを形成します。次のステップで、アントラキノンは再び水素でアントラヒドロキノンなどに還元できます。総式は次のとおりです。
実験室規模では、酸による過酸化物の処理でも過酸化水素が生成されます。歴史的に重要な試薬は過酸化バリウムで、硫酸溶液中で反応して過酸化水素と硫酸バリウムを生成します。
生成のモルエンタルピーは次のとおりです:
- Δf Hガス :−136.11 kJ/mol
- Δf Hリク :−188 kJ/mol
- Δf Hソル :−200 kJ/mol
化学的性質
過酸化水素は水と酸素に分解する傾向があります。これにより、98.02 kJ/mol のエネルギーが放出されます:
-
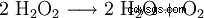
- 2 分子の過酸化水素の水と酸素への不均化。
この分解反応は、とりわけ、Mn (証拠を参照) または他の重金属イオン、I および OH イオンによって触媒されます。したがって、H2 O2 ・市販の溶液には安定剤(リン酸を含む)が配合されています。強力な酸化剤です。酸化状態が-Iから-IIに低下すると、反応生成物として水と酸素のみが形成されます。分離が困難または破壊的な副産物がないため、実験室での使用が簡素化されます。
また、より強力な酸化剤 (過マンガン酸カリウムなど) に対する還元剤としても機能します。
過酸化水素は非常に弱い酸です。その無機塩と有機エステルは、ヒドロペルオキシドとペルオキシドです。
証明
定性的な検出には、Mn イオン (例:MnSO4 )認めた。ガスが発生した場合は、くすぶりチップ試験を使用して酸素をチェックします。これが陽性であることが判明した場合、光るチップが光るという点で、H2 は O2
- 過酸化クロム (CrO(O2 )2 )
祭りのリハーサルから作る。三酸化クロム CrO3 強酸性範囲 (pH <0) で過酸化水素を使用すると、エーテルに溶解する強烈な青色の過酸化クロムが得られます。これを行うには、希H2を含む二クロム酸カリウム SO4 酸性化し、1 cm のエーテルで覆い (控除!)、サンプルを加えて振とうします。エーテル相が青みがかった色に変わります。
- ペルオキソチタニル(IV)イオン([Ti(O2 )ああ])
「チタンイエロー」(同名の染料と混同しないでください)による検出は、非常に感度の高いものです。 (無色の) チタン (IV) イオンは、微量の過酸化水素を含んでいても、濃い橙黄色のペルオキソチタニル イオンを生成します。逆に、物質は過酸化水素を用いてチタン (IV) について検査することもできます。
- 過マンガン酸カリウムによる検出
水溶液中の濃度を決定するには、例えばB. 漂白浴. 決定は、n/10 過マンガン酸カリウムの硫酸溶液を用いてオキシメトリーで行います (永久的な淡いピンク色に変化します (約 1 分間続きます))。
生理学
過酸化水素は、特に蒸気として非常に腐食性があります。皮膚に過酸化水素が付着した場合は、その部分を水でよく洗い流す (希釈する) か、少なくともすぐに皮膚から取り除いてください。それはすぐに皮膚細胞を殺し、それから白くなります.
一般に、過酸化水素には細胞毒性があり、多くの原核微生物に対する毒性が強いため、消毒効果があります。
過酸化水素は、多くの生化学プロセスで形成されます。生物学的サイクルでは、糖の酸化的代謝によって形成されます。有機体は、カタラーゼ、ペルオキシダーゼなどの酵素の助けを借りて、毒性のない O2 に戻すことで、その毒性から身を守っています。 と H2 O を分解します。
精子による受精後、女性の卵細胞は低濃度の過酸化水素を一時的に生成して他の精子を殺します.
さらに、過酸化水素は、病原体に対する植物の防御を誘導するシグナル伝達分子です (細胞毒性の側面)。
使い方
ブリーチ
過酸化水素は漂白剤であるため、髪を漂白し、歯を白くするために化粧品に使用されています.カルバミドに結合した過酸化物としてよく使用されます。
- プラチナ ブロンド、髪の色を最大限に回避する人類は、過酸化水素のおかげです。非常に反応性の高い液体が、髪の色素を破壊します。
世界中で、環境に優しいパルプの漂白に最大の用途が見られます。パルプは、木材とそれに含まれるリグニンと H2 から得られます。 O2 漂白した。パルプの主な用途は、紙、ナプキン、ハンカチなどの製造です。
手工芸品では、過酸化水素は木を漂白するために、つまり明るくするために使用されます。 B. 修復または改修中。
過酸化水素またはペルオキシ酢酸と過酸化水素の混合物などの過酸化水素を含む漂白剤も、活性酸素という人工的な言葉で広告に使用されます。
消毒と滅菌
消毒のために、過酸化水素は、口とのどに 3% 溶液として使用されます。 B. 歯科;また、コンタクトレンズクリーナーでコンタクトレンズを消毒したり、包装材料を殺菌したり、手を消毒したりするためにも使用されます.また、毛穴を開き、にきびや傷と戦うために顔のスキンクリームにも使用されています.工業廃水の浄化やプールの水の消毒によく使用されます。
食品業界では、ペットボトルを滅菌する無菌充填システムで 30% 過酸化水素が使用されています. 多くの食品 (飲料、牛乳、乳製品、ソース、スープなど) は、改善のためにカートン、カップ、ボトル、ホイルに無菌的に包装されています.賞味期限と製品の品質。最も一般的に使用されるプロセスは、濃縮過酸化水素 (35%) による滅菌に基づいています。 H2の高い殺菌効果 O2 、環境適合性と優れた技術的実現可能性が、このプロセスが広く使用されている理由です。運用上の実践では、スプレーと浸漬浴プロセスが区別されます。
酸素供給
過酸化水素は、水槽で酸素を供給するために使用できます。酸素は酸化装置で生成されます。これを行うために、過酸化水素は水槽内の容器内で触媒の助けを借りて水と酸素ラジカルに分解されます。
複数の効果を同時に使用
インテリアを改装するときは、過酸化水素を使用してカビの成長を抑えることができます.消毒剤として、生物学的に活性な細胞を殺し(殺菌剤)、胞子を破壊する(殺胞子剤)ことができます。また、漂白剤としても使用できません コーティングの残留物を除去 - 白い多孔質表面 - 「光学的に無害」。過酸化水素はアルコールや次亜塩素酸ナトリウムよりも好ましい。 B. 下層土の塩が生成する可能性があります。アルコールは、過酸化水素と比較して、殺胞子効果も漂白効果もありません。
過酸化水素は、骨の準備における漂白および消毒にも使用されます。歯科では、H2 O2 歯組織の局所消毒と、軽度の介入中の止血に使用されます。
農業では、過酸化水素は温室の消毒と水耕培地の酸素化に使用されます。
生物学
細菌培養を決定するために、カタラーゼ試験は 3% 過酸化水素溶液で実施されます。ほとんどの好気性および通性嫌気性細菌、および真菌は、細胞にとって有毒な H2 を分解できる酵素カタラーゼを持っています。 O2
過酸化水素は、法医学で血液を検出するために使用できます。 1818年、ルイ・ジャック・テナールは、ヘモグロビンのペルオキシダーゼが過酸化水素を分解することを発見しました。クリスチャン・フリードリッヒ・シェーンバインは、1863 年にこれに基づいて血液検査を開発しました。しかし、今日では、より感度の高い Kastle-Meyer テストが血液の検出に使用されています。
実験的に、過酸化水素は、単離された真核細胞でプログラム細胞死を誘導するために生物学で使用されています。
コースティクス
マイクロエレクトロニクスでは、「ピラニア」と呼ばれる硫酸と過酸化水素の混合物を使用して、ウエハーの表面を洗浄し、ウエハー上に薄い約 3 ~ 4 nm の厚さの親水性酸化物層を生成します。現在、「SPM」(過酸化硫黄混合物)という用語がより一般的になっています。主な用途はフォトレジストの除去です。
プリント回路基板 (PCB) の製造では、銅を除去するために塩化銅エッチング液が使用されます。
-
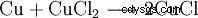 .
. - 銅元素は塩化銅(II)と反応して塩化銅(I)を形成します。これは均衡です。
過酸化水素は塩酸と一緒に使用され、塩化銅エッチング液を再生します:
-
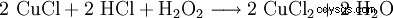 . 塩化銅(II)は、塩化銅(I)を過酸化水素および塩酸と反応させることによって再生される。銅原子が酸化されています。
. 塩化銅(II)は、塩化銅(I)を過酸化水素および塩酸と反応させることによって再生される。銅原子が酸化されています。
過酸化水素と塩酸の添加は、酸化還元電位によって制御されます。
ロケット/魚雷エンジン
エネルギーと酸素の供給源 (二酸化マンガンによる分解など) として、ロケット ドライブ (例:マックス ヴァリエ、メッサーシュミット Me 163) や潜水艦ドライブ (ウォルター U ブート) で濃縮された形で使用されました。過マンガン酸カリウムの助けを借りて分解された過酸化水素は、A4 の燃料ポンプ (500 hp) の推進剤としても使用されました。未分解の過酸化水素は常温で液体の酸素運搬体として英国のロケット (例えばブラック アロー) で使用され、そこで灯油と一緒に燃焼されました。
過酸化水素は制御不能に分解する傾向があります。そのため、1934 年 7 月 16 日に死亡しました。クマースドルフで、過酸化水素を燃料とするエンジンの爆発を目撃したクルト ワームケと 2 人の技術者。使用と取り扱いにおける危険性 (腐食効果、制御不能な分解、タンクとパイプ システムが汚染されている場合の爆発) のため、現在、使用は小型ロケット エンジンに限定されています (試行の記録、エンジンの制御)。
ロシアの原子力潜水艦クルスクの沈没 2000 年には、過酸化水素が魚雷のタンクから漏れ、銅部品と反応して魚雷が破裂したことが原因であると噂されていました。
爆薬製造
適切な触媒の存在下で、過酸化水素はアセトンと反応して過酸化アセトンを形成します。過酸化アセトンは爆発物ですが、取り扱いが非常に危険なため商業的には使用されていません。より正確には、過酸化アセトンは、TATP と略されるトリアセトン トリペルオキシドとも呼ばれます。過酸化水素で作られた他の爆薬には、ヘキサメチレン トリペルオキシド ジアミン (HMTD) があります。
Fraunhofer Institute for Chemical Technology の専門家によると、TATP はイスラエルのほとんどの自爆テロに使用されています。 2005 年 7 月 7 日のロンドン地下鉄への攻撃 (死者 55 名) も TATP を使って実行されたと言われています。最後に、2007 年 9 月 4 日、パキスタンで訓練を受けた 3 人のイスラム主義者が、ザウアーラント州オーバーシュレドルンで逮捕されました。彼らは、米国市民が頻繁に訪れるドイツの米国の施設やレストランを攻撃するために、730 キログラムの 35% 過酸化水素溶液から TATP を生成することを望んでいました。
一方、専門家は、テロリストが制御された方法で過酸化水素で作られたTATPを爆発させる方法を詳しく知りません.特に、2007 年にロンドンで飛行機に液体爆薬を密輸する試みが阻止された際、密輸された過酸化水素とアセトンのボトルを使用して適切な過酸化アセトンを機内で製造できるかどうかが疑問視されました。
参考文献
- Werner R. Thiel:過酸化水素への新しいルート:確立されたプロセスに代わるもの? Angewandte Chemie 111(21)、pp. 3349-3351 (1999)
- Heribert Offermanns、Gunther Dittrich、Norbert Steiner:環境保護と合成における過酸化水素 .私たちの時代の化学 34(3)、pp. 150–159 (2000)、ISSN 0009-2851